2025年11月27日,歐盟委員會在官方公報上發布Commission Decision (EU) 2025/2371決議,正式確認EUDAMED數據庫中首批四個核心模塊已達到完全功能規範要求。這一公告標誌著歐盟醫療器械監管數字化邁入實質性落地階段。根據決議,從2025年11月27日起的6個月過渡期結束後,即2026年5月28日,這些模塊的使用將從自願轉為強製性法律義務。
01 歐盟EUDAMED分步實施策略正式落地
EUDAMED數據庫是歐盟醫療器械法規(MDR)和體外診斷器械法規(IVDR)的核心組成部分。該係統原計劃作為一個整體一次性上線,但因開發複雜度高而調整為成熟一個,上線一個的漸進式實施策略。2024年6月通過的歐盟條例2024/1860為這一分步走策略提供了法律基礎,允許每個模塊在獨立完成審計並宣布功能齊全後,便可單獨投入強製使用。本次決議正是這一策略下的首個裏程碑,意味著EUDAMED實施進入了最後的 “強製倒計時”階段。
02 四大核心模塊的功能解析
首批強製實施的四個模塊構成了EUDAMED係統的“基礎骨架”,解決了“誰在賣”、“賣什麼”以及“是否有證”的核心透明度問題。
經濟運營商注冊模塊(Actor Registration)
所有在歐盟市場運營的醫療器械製造商、授權代表和進口商必須在此模塊完成注冊,並獲得單一注冊號(SRN),該號碼將作為其在所有歐盟官方文件中的唯一身份標識。
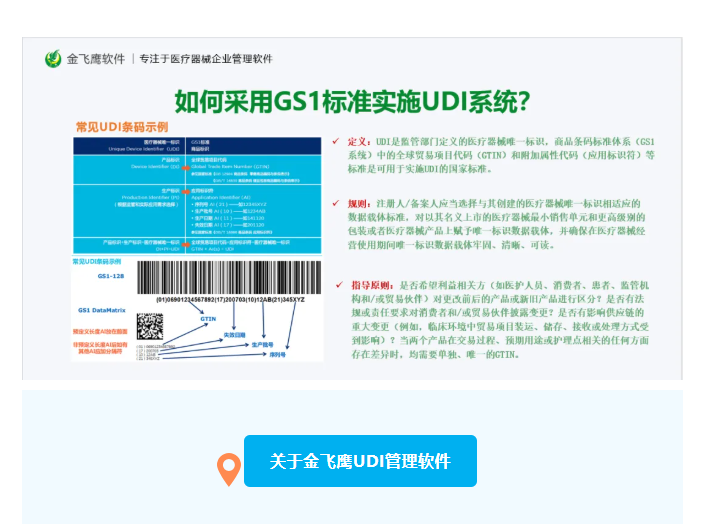
UDI/器械注冊模塊(UDI/Device Registration)
製造商必須在此模塊中注冊所有投放歐盟市場的醫療器械(定製器械除外)。注冊需要提供詳細的產品信息,包括Basic UDI-DI、器械風險等級、商品名、型號、UDI詳細信息(UDI-DI、UDI-PI)以及歐洲醫療器械命名(EMDN)代碼等。
公告機構和證書模塊(Notified Bodies & Certificates)
此模塊集中管理所有在歐盟境內運營的公告機構信息及其頒發的證書數據,提高監管透明度和證書可追溯性。
市場監督模塊(Market Surveillance)
該模塊旨在加強歐盟市場監督機構之間的信息交流,便於對不符合要求的醫療器械采取協調一致的市場監管措施。
03 “6-12-18”黃金時間表:企業合規倒計時
針對已啟用的四大模塊,根據Regulation (EU) 2024/1860的修正案,合規義務按照T(2025年11月27日)為基準點,分三個關鍵節點落地。
節點一:T+6個月(2026年5月28日)
含義:EUDAMED正式成為MDR/IVDR的法定合規環境。從這一天起,所有涉及這四個模塊的新增合規動作(如新申請SRN)必須在係統中進行。
節點二:T+12個月(2026年11月27日)
核心義務:這是一個硬性死線。在此日期前,製造商必須確保所有正在投放市場的器械(包括MDR/IVDR證書器械以及利用過渡期的Legacy Devices)在EUDAMED中完成注冊。
警告:逾期未注冊的器械,可能麵臨被海關扣留或被勒令停止銷售的風險。
節點三:T+18個月(2027年5月27日)
裏程碑:公告機構完成MDR/IVDR證書及SSCP上傳
核心義務:公告機構必須在此日期前將有效的CE證書以及III類/植入式器械的SSCP(安全與臨床性能總結)上傳至EUDAMED供公眾查詢。
04 遺留器械與定製器械的特殊要求
對於遺留器械,雖然大多數MDR/IVDR要求不適用,但必須在EUDAMED中完成注冊。沒有Basic UDI或UDI-DI時,可使用虛擬UDI完成注冊。定製器械根據MDR第29、30和31條,可豁免在UDI/器械模塊中的注冊要求。但定製器械製造商的注冊要求可能變得更複雜,可能需要根據各成員國要求向主管當局提交清單。
05 IVDR製造商同樣適用,切勿心存僥幸
特別需要提醒的是,IVD製造商切勿心存僥幸。本次強製倒計時同樣適用於IVDR下的體外診斷器械。根據決議及IVDR Article 113(3),EUDAMED是MDR和IVDR共用的數據庫係統。本次決議確認驗收合格的四個模塊,同時也涵蓋了IVDR Article 30(2)所列出的對應電子係統。因此,無論產品是依據IVDD指令的遺留器械,還是已經獲得IVDR證書的新器械,都需要在2026年11月27日這一截止日期前完成SRN注冊、UDI/器械數據錄入和證書信息核對。
06 企業應對策略:立即行動,勿拖延
行業專家強調,企業不應低估EUDAMED準備的複雜性。EirMed公司CEO Richard Houlihan指出:“EUDAMED是一個項目,需要時間來準備。不要等到最後一分鍾,屆時幫助您理解EUDAMED複雜性的資源可能已經不夠用了。”
2025年12月-2026年3月:收集並準備所有上市器械的注冊數據
2026年4月-5月:完成EUDAMED中的數據上傳工作
2026年5月28日起:確保四大模塊正式強製使用後,相關注冊和申報依法進行
07 未來展望:剩餘模塊的實施安排
隨著首批四個模塊的實施塵埃落定,行業關注點將轉向剩餘兩個模塊的實施時間表:臨床調查/性能研究模塊和警戒係統模塊。根據相關討論,警戒模塊預計將在2026年第4季度發布Notice,預計將於2027年第2季度正式轉為強製。目前仍然繼續沿用當前的過渡方案(MIR表格+郵件/國家門戶)。臨床調查/性能研究模塊目前仍然處於開發階段,當前仍需要繼續遵循各成員國的國家要求。EUDAMED四大模塊的強製實施標誌著歐盟醫療器械監管向著更高透明度、更強可追溯性和更嚴監管的目標邁出了關鍵一步。對醫療器械企業而言,數字化合規時代已正式開啟,抓緊最後6個月的窗口期,完成數據的清理與遷移,才是應對這一監管變革的明智之舉。立即行動,切勿拖延——這是所有醫療器械製造商麵對EUDAMED強製合規倒計時的唯一選擇。金飛鷹UDI管理軟件:核心功能,直擊政策剛需
1. 一鍵生成全球合規編碼
支持多國標準:內置中國NMPA、美國FDA、歐盟MDR、加拿大等法規要求,自動識別地區碼並轉換;
智能賦碼:輸入產品批號/序列號規則,係統自動生成一維碼、二維碼或RFID標簽,避免人工編碼錯誤;
DI+PI動態組合:設備標識符(DI)與生產標識符(PI)實時綁定,確保唯一性。
2. 全流程追溯,滿足監管“零容忍”
三級追溯體係:從生產計劃、打印工單、再到打印記錄,全程數據可溯源;
審計留痕:所有操作記錄(如標簽打印、數據修改、報廢補打等)自動存檔,支持監管部門隨時調取。
3. 硬件無縫對接
兼容主流設備:與掃碼槍、PDA、工業讀碼器等硬件互通,生產線上實時掃碼錄入數據;
多設備協同:支持多台硬件同時作業,提升數據采集效率,減少人工幹預。
金飛鷹UDI管理軟件——讓醫療器械唯一標識實施更簡單、更高效、更安全!
信息來源:歐洲聯盟
排版整理:金飛鷹藥械