近日,國家藥監局正式發布2025年版《醫療器械生產質量管理規範》,標誌著我國醫療器械生產監管進入全新階段。與2014版相比,新版規範在結構、理念、內容上均實現全麵升級,對企業質量管理體係提出更高、更細、更嚴的要求。
本文將帶您快速梳理2025版與2014版的核心差異,助力企業提前布局、合規發展。
一、整體理念:從“有”到“優”,體係全麵升級
2025版規範共15章132條,相比2014版的13章84條,不僅在結構上更加完整,更在理念上實現三大升級:
體係化:質量保證不再分散,而是係統化、閉環化;
全程化:覆蓋從設計開發到售後服務的全生命周期;
精準化:針對UDI、電子數據、委托生產等新業態提出明確要求。
二、新增三大章節,補齊監管短板
新版規範首次獨立設立以下三章,係統性強化關鍵環節:
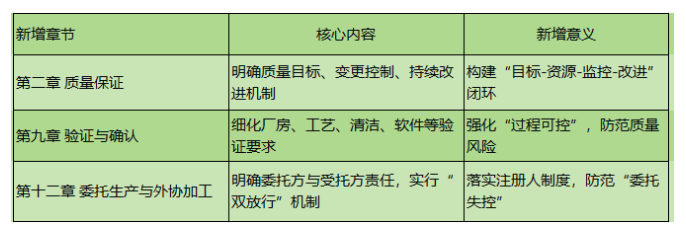
三、人員資質:要求更具體、更嚴格
2025版對關鍵崗位人員的學曆、職稱、工作經驗提出明確量化要求,杜絕“掛名”現象:
管理者代表(二/三類):本科及以上學曆或中級職稱 + 3年以上經驗
質量部門負責人(二/三類):本科 + 中級職稱 + 3年以上經驗
生產部門負責人:專科及以上 + 3年以上經驗
四、文件與數據管理:迎接數字化監管時代
新版將“數據管理”提升至與“文件管理”同等重要地位,明確:
電子記錄、電子簽名、數據備份等信息化要求;
建立偏差處理程序,清場管理納入批記錄;
記錄保存期不少於2年,且與產品壽命期一致。
五、設計開發與生產追溯:控製前移、全程可溯
設計開發:強調“設計轉換”,確保從實驗室到生產的穩定性;
委托設計:明確委托方評估與管理責任;
UDI實施:強製推行醫療器械唯一標識,實現全流程追溯。
六、委托生產:權責清晰,“雙放行”不可委托
2025版首次明確:
委托方對產品全生命周期質量負總責;
受托方對生產過程負責;
上市放行由委托方執行,不得委托。
七、分析與改進:形成質量管理閉環
新版將投訴、不良事件、CAPA、召回、內審、管理評審整合為獨立章節,強調數據驅動的持續改進機製,推動企業實現自我完善。
總結:企業應如何應對?
2025版規範的發布,是對醫療器械企業質量管理能力的一次“大考”。企業應盡快:
(1)對標自查,識別現有體係與新版要求的差距;
(2)強化人員配置,確保關鍵崗位符合資質;
(3)完善數據與文件係統,適應數字化監管;
(4)梳理委托生產流程,明確雙方權責;
(5)建立全生命周期質量管理機製,實現持續改進。
溫馨提示:
本文僅為差異要點解讀,具體執行請以官方正式發布的《醫療器械生產質量管理規範(2025年版)》全文為準。
如需獲取完整版規範或專業合規谘詢,歡迎在評論區留言或私信聯係我們!
信息來源:國家藥監局
排版整理:金飛鷹藥械



