歐盟MDD認證證書維持
- 立即谘詢
-
全國服務熱線:
400-888-7587

400-888-7587
♛ 辦理介紹 / Introduction
✪ CE為法文CONFORMITE EUROPEENNE的首字母縮寫,表示“歐洲統一”,也代表產產品安全。
✪ CE適用的區域包括:歐盟EU+歐洲經濟區EEA+東歐,共31個國家。很多除歐盟外的國家,除美國FDA、日本PAL、澳大利亞TGA等,絕大數通行歐洲頒發的自由銷售證書CFS。
| 法國 | 德國 | 英國 | 愛爾蘭 | 意大利 | 比利時 | 荷蘭 | 西班牙 |
| 葡萄牙 | 盧森堡 | 瑞典 | 芬蘭 | 奧地利 | 波蘭 | 匈牙利 | 希臘 |
| 捷克 | 斯洛伐克 | 斯洛文尼亞 | 拉脫維亞 | 立陶宛 | 塞浦路斯 | 馬耳他 | 羅馬尼亞 |
| 丹麥 | 愛沙尼亞 | 保加利亞 | 冰島 | 挪威 | 瑞士 | 土耳其 |
✪ CE標誌是一種安全認證標誌,凡貼有CE標誌的產品均可在歐盟各成員國內銷售,無須符合各個成員國的要求。使用CE標誌,實現了商品在歐盟成員國範圍內的自由流通,因此CE標誌被視為製造商打開並進入歐洲市場的通行證。
✪ 在歐盟市場“CE”標誌屬強製性認證標誌,不論是歐盟內部企業生產的產品,還是其他國家生產的產品,要想在歐盟市場上自由流通,就必須加貼“CE”標誌,以表明產品符合歐盟《技術協調與標準化新方法》指令的基本要求, 加貼“CE”標誌必須識別很多協調標準,這是歐盟法律對產品提出的一種強製性要求。
✪ 歐盟對醫療器械的監管,主要是依據三大指令來實現的,大部份醫療器械產品均需要通知歐盟監管機構認可的公告機構來完成,隻有少部份MDD中的普通一類,IVD設備中的其它類及自測設備,才可以由製造商通過自我聲明的方式在歐盟境內銷售。
♛ 歐洲三大醫療器械指令介紹:
✪醫療器械指令
名稱 | 指令 | 發布日期 | 生效日期 |
醫療器械指令 | 93/42/EEC,MDD | 1993-6-14 | 自1995-1-1起 |
體外診斷器械指令 | 98/79/EC,IVDD | 1998-10-27 | 自2000-6-7起 |
有源植入器械指令 | 90/385/EEC,AIMDD | 1990-6-20 | 自1993-1-1起 |
✪2007,9,5 針對93/42/EEC指令和90/389/EEC 指令的修改指令正式頒布在歐盟的官方公告上,2010,3,21 上市或投入使用的醫療器械產品必須符合修訂後指令的要求。
✪2017年5月5日,2017/745、2017/746法規頒布,取代了原來的三大指令,新法規有三年過渡期,將在法規頒後的三年後強製實施。
♛ 歐盟醫療器械CE認證經常用到的醫療器械協調標準、指南及其它指令如下(93/42/EEC,MDD):
名稱 | 協調標準 | 名稱 | 協調標準 |
| 質量管理體係 | EN ISO 13485 | 臨床調查 | EN ISO 14155 |
包裝 | EN 868-X | 風險分析 | EN ISO 14971 |
生物學評估 | EN ISO 10993-X | 標簽&符號 | EN 1041 & ISO 15223 |
滅菌 | ISO11135,11136,11137 | 醫用電氣安全 | EN 60601-1 |
可用性評價 | IEC62366 or IEC60601-1-4 | 醫療軟評評價 | IEC62306 |
機械指令 | 2006/42/EC | 無線電指令 | 1999/5/EC |
有害物質指令 | 2011/65/EU | 防護設備指令 | 89/686/EEC 指令 |
臨床評價指南 | MEDDEV 2.7.1 ver.4 | 警戒係統指南 | MEDDEV_2_12_1 |
上市後臨床研究指南 | MEDDEV_2_12_2 | 飛行檢查指南 | 歐盟2013/473/EU |
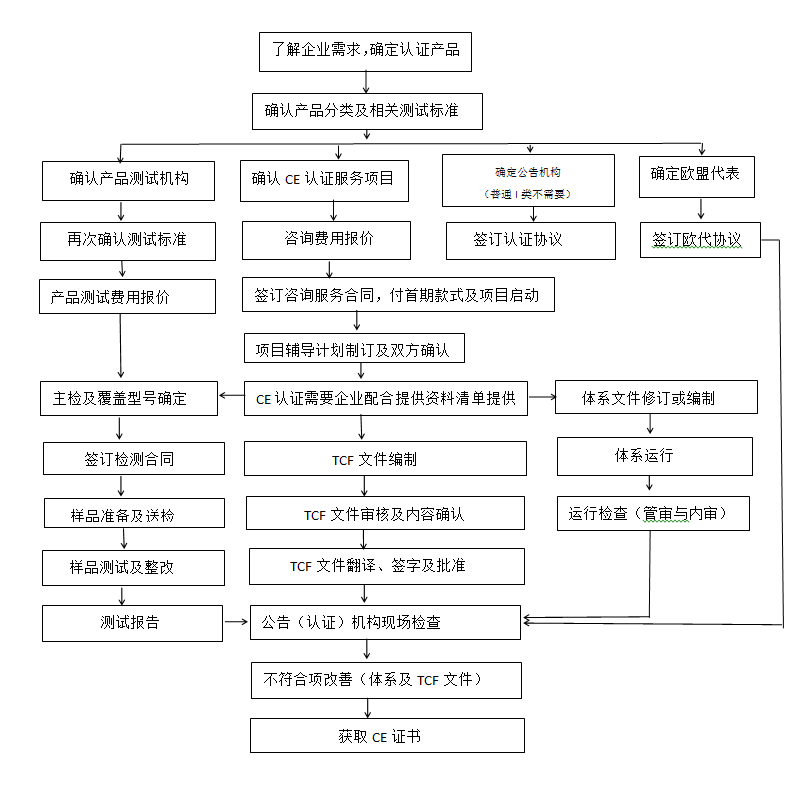
㉿ 辦理流程 / Processing process
CE認證流程(以93/42/EEC指令為例)
〠 金飛鷹相關服務 / Golden Eagle related services
序號 | 項目 | 服務內容 | 說明 |
1 | 培訓服務 | ✪與產品認證有關的指令培訓 ✪與產品認證有關的標準培訓 ✪TCF文件編製要求培訓 ✪臨床評價、警戒、上市後跟蹤、飛行檢查等指南性文件培訓 ✪EN ISO13485:2016標準、EN ISO14971:2012標準培訓 ✪可用性工程標準、軟件評價標準培訓 ✪工藝驗證與確認培訓 ✪歐盟GMP要求培訓 | ●工藝驗證與確認培訓指無菌產品的滅菌,內包裝等特殊與關健工序 ●歐盟GMP要求培訓指無菌產品的要求 |
2 | 谘詢輔導服務 | ✪產品分類 ✪上市途徑選擇 ✪產品檢驗方案確定 ✪公告(認證)機構推薦及後期工作聯絡 ✪測試機構推薦及檢測進度跟蹤 ✪檢測報告合規性審核 ✪歐盟代表機構推薦 ✪取證後歐盟法規跟蹤服務 符合歐盟GMP要求的廠房硬件驗證(空調,水處理設備等) ✪潔淨車間設備與設施驗證 ✪滅菌,內包裝及識別的特殊過程與關健工序驗證 | ●產品檢驗方案確定 含生物學測試方案 ●符合歐盟GMP要求的廠房硬件驗證(空調,水處理設備等)指無菌產品的要求 |
3 | 文件編製或修訂 | ✪體係文件編製或修訂 ✪臨床評價文件編製 ✪TCF文件編製 ✪與CE認證有關的資料翻譯 | 自1993-1-1起 |
| 4 | 檢查與監督 | ✪文件運行輔導及日常檢查 ✪組織管理評審與內審 ✪模擬檢查 ✪現場檢查陪審 ✪不符合項改善指導及審核 | |
| 5 | 其它 | ✪三類醫療設備臨床試驗途徑確認 ✪已經獲證CE認證產品技術文件修改 ✪已經獲證CE認證產品增加認證係列 ✪CE認證產品生物學評價 ✪三類認證產品設計證書輔導 |
服務電話 固話:0755-86194173 手機:13502837139 | 在線客服 | 營銷中心 深圳市南山區南頭街道前海路3101號-90振業國際商務中心2405b |
服務電話 固話:020-82177679/020-82176911 手機:13602603195 |  | |
在線客服 | ||
營銷中心 廣州市黃埔區科學大道50號(廣州綠地中央廣場)A3棟1906 |
全麵解決您的研發、生產、驗收、營銷全流程問題

practical experience
2000多個二、三類醫械項目經驗沉澱,為你分配做過相同案例的實戰老師。
Professional translation
彙聚7大語種專業翻譯精英,多年醫械行業翻譯經驗,能準確翻譯專業名詞及用語。
Software development
強大的軟件研發團隊,已為集團研發出成熟的項目管理軟件,可提供軟件定製服務。
Group supply chain
嚴選數十個優秀的醫械行業服務機構,可為客戶推薦更實惠的醫械配套服務。
多次創造二三類高風險產品一次性通過的行業紀錄
項目狀態:已結案
項目輔導老師:李老師
項目狀態:已結案
項目輔導老師:車老師
項目狀態:已結案
項目輔導老師:王老師
項目狀態:已結案
項目輔導老師:黃老師